Într-un articol anterior am făcut o introducere în teoria curentului electric, completând cu două videoclipuri explicative. În acest articol găsiți completarea din acele clipuri sub formă de text.
Imaginează-ți că ai un circuit uriaș format dintr-o baterie, un întrerupător, un bec și două fire, fiecare având 300.000 de kilometri lungime. Aceasta este distanța pe care o parcurge lumina într-o secundă. Deci, firele ar ajunge până la jumătatea drumului spre Lună și s-ar întoarce pentru a se conecta la bec, care se află la un metru distanță.
Acum, întrebarea este: după ce închid întrerupătorul, cât timp va trece până se aprinde becul? O jumătate de secundă, o secundă, două secunde, 1/c secunde sau niciuna dintre variante?
- Detalii
- de: Iosif A.
- Atomul

Sonda Galileo
În vid, cum este cazul în spațiul cosmic, două bucăți de metal identic se pot suda pur și simplu, la contact. Acest fenomen se numește „sudură la rece”.
- Detalii
- de: Iosif A.
- Atomul

Explozia bombei cu hidrogen Ivy Mike2
Recent, Israelul a vizat trei dintre principalele locații unde Iranul își derulează programul nuclear, Natanz, Isfahan și Fordow, ucigând mai mulți oameni de știință iranieni din domeniul nuclear. Locațiile acestor instalații sunt puternic fortificate și în mare parte subterane; rapoartele privind amploarea pagubelor sunt deocamdată contradictorii.
La Natanz și Fordow sunt instalațiile iraniene de îmbogățire a uraniului, iar de la Isfahan se furnizează materiile prime, așadar orice deteriorare a acestora ar limita capacitatea Iranului de a produce arme nucleare.
Dar ce înseamnă, mai exact, îmbogățirea uraniului și de ce generează îngrijorări?
- Detalii
- de: Kaitlin Cook
- Atomul
Fizicieni de la MIT au ajutat la crearea unui videoclip în care, pentru prima oară, mărimile, formele și structurile nucleelor atomice sunt vizualizate cu ajutorul unor animații. Mai jos, puteți vedea respectivele animații, însoțite de textul explicativ:
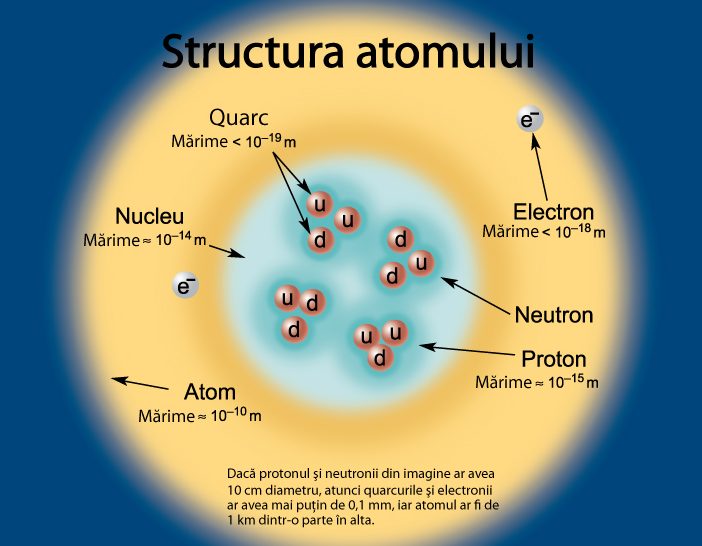
Omul s-au întrebat încă de acum mii de ani despre structura materiei și despre ce anume constituie lumea noastră. Filosoful grec Democrit a dezvoltat pentru prima dată conceptul de „atomos”, un bloc indivizibil din care se formează materia. El credea că atomii aveau multe forme, în funcție de tipul de materie pe care îl alcătuiau.
Peste două milenii mai târziu, aceste forme au fost unificate în sfere solide. În jurul anului 1900, a fost descoperit electronul, despre care s-a propus că există dispersat în interiorul sferei. Câțiva ani mai târziu a fost descoperit nucleul, iar modelul atomic a evoluat.
- Detalii
- de: MIT
- Atomul

Imagine atom fier
O nouă tehnologie, denumită SX-STM (synchrotron X-ray-scanning tunneling microscopy), permite „fotografierea” unui atom cu ajutorul razelor X, detectarea tipului de atom analizat, precum și măsurarea simultană a stării chimice a atomilor.
Într-un articol recent publicat în revista Nature de mai mulți cercetători din SUA se arată că, folosind un detector specializat, aceștia au reușit să descrie identitatea și starea chimică a unui singur atom.
Scanarea cu efect de tunel (scanning tunnelling microscopy / STM) este o tehnică de scanare inventată în 1981 care se bazează pe efectul tunel (fenomen cuantic). Pe măsură ce capul microscopului scanează suprafața substanței studiate, electronii se transferă (prin efectul tunel) către suprafața respectivă. Curentul de tunelare este măsurat și poate fi transformat într-o imagine.
- Detalii
- de: Iosif A.
- Atomul
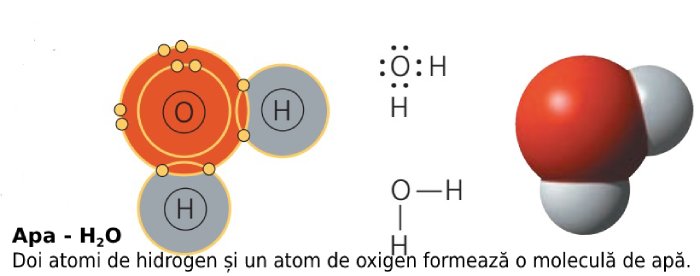
Atomii sunt particule compozite (adică formate din alte particule) foarte mici. Nu-i putem observa cu ochiul liber. Dar aceștia stau la baza materiei din jurul nostru, precum și a celulelor care ne formează corpul.
Dar dacă atomii sunt așa mici, există o cale pentru a calcula, de pildă, câți atomi sunt într-o anumită cantitate de apă?
- Detalii
- de: Iosif A.
- Atomul

Vibraţie a unui electron
Reamintesc pentru puținii cititori ai site-ului care nu sunt familiarizați cu structura de bază a unui atom că electronii sunt particule elementare, care împreună cu nucleul atomului (care poate conține protoni și neutroni, particule compozite formate la rândul lor din quarcuri) formează sistemul atomului.
Conform fizicianului Michael Dine, specializat în fizica particulelor, electronul se deplasează în cadrul unui atom cu o viteză de circa 1% din c, viteza luminii în vid.
- Detalii
- de: Iosif A.
- Atomul

Electricitatea, un „lucru” ubicuu în societatea umană de multă vreme, este, în parte, la nivel fundamental un mister. Ați putea explica cum funcționează, în fapt, curentul electric? Dacă veți spune că este vorba de „mișcarea electronilor” nu veți lămuri subiectul, pentru că această metaforă, deși utilă, nu explică fenomenul. De exemplu, în cazul curentului electric alternativ, cel pe care-l folosiți zi de zi, despre ce „mișcare a electronilor” vorbim? Pentru că ei se mișcă ba spre casa ta, ba spre locul de generare. Electronii, aparent, se apropie și se îndepărtează permanent. Atunci ce se mișcă? Ce este, în fapt, curentul electric?
- Detalii
- de: Iosif A.
- Atomul

Există patru interacțiuni fundamentale în univers, pe care le cunoașteți cu certitudine: gravitația, interacțiunea electromagnetică, interacțiunea nucleară tare și interacțiunea nucleară slabă. Primele două acționează la distanțe practic nelimitate, ultimele la distanțe foarte mici (10-15 m și 10-16 m).
Electronii (-) și protonii (+), particule de semn opus, se atrag ca urmare a interacțiunii electromagnetice, ceea ce explică faptul că aceste componente ale atomului sunt ținute împreună.
- Detalii
- de: Iosif A.
- Atomul

Am scris recent un articol despre radiația termică și despre faptul incredibil că organismul uman (împreună cu toate obiectele din acest univers) în mod natural emite constant o cantitate impresionantă de radiație electromagnetică. În acest articol un subiect cu o temă apropiată: cum anume se încălzește un corp sub acțiunea radiației termice, cum ar fi atunci când se află sub acțiunea razelor solare? Ce se întâmplă la nivel atomic?
- Detalii
- de: Iosif A.
- Atomul
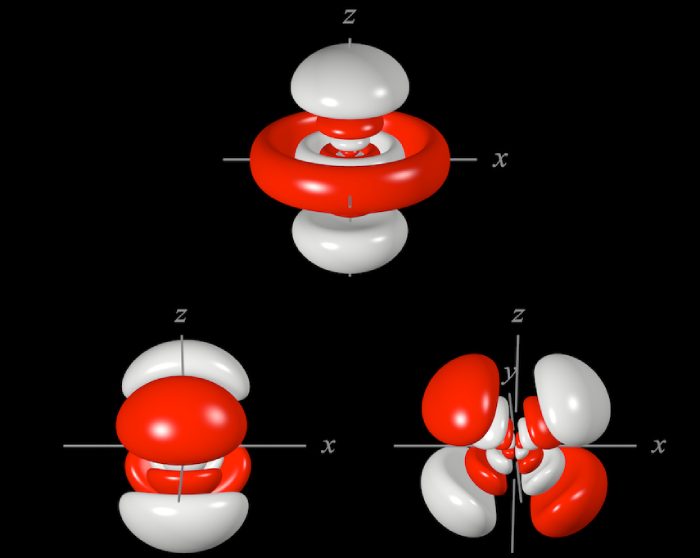
Orbitali atomici, substratul 6d
Fiecare tip de atom are un număr de electroni distinct, care este identic cu numărul de protoni (atunci când numărul de electroni este diferit, vorbim de ioni). Atomul de hidrogen, de exemplu, care este cel mai simplu atom, are un electron, dar atomul de aur are 79 de electroni. Electronii sunt distribuiți în cadrul învelișului electronic după reguli foarte stricte. Iată în continuare tot ce trebuie să știți despre distribuirea electronilor în cadrul unui atom.
- Detalii
- de: Iosif A.
- Atomul

Atomii sunt formați din electroni, particule elementare organizate în straturi electronice la exteriorul atomului, și nucleu. Nucleul aste format din protoni și neutroni, care nu sunt însă particule elementare, ci, la rândul lor, sunt formate din alte particule, de care știm că ar fi elementare (nu sunt alcătuite din ale particule) denumite quarcuri.
- Detalii
- de: Iosif A.
- Atomul

Electronii unui atom sunt organizați în orbitali.
Nenumăratele puncte pe care le vedeți nu reprezintă electroni, ci posibile poziții în spațiu pentru un electron, dacă încerci să-l măsori.
În urmă cu trei ani am scris un articol intitulat „De ce obiectele opun rezistență la atingere”, pe care-l începeam așa: „Simplificând un pic, dacă atomul ar fi de dimensiunea unui teren de fotbal, nucleul atomic ar fi de dimensiunea unui nasture. Restul - spaţiu gol”.
Trebuie admis că am simplificat un pic mai mult...
- Detalii
- de: Iosif A.
- Atomul

Atomul de hidrogen (reprezentare grafică), format dintr-un proton şi un electron
Numărul atomic, notat cu litera Z, indică numărul de protoni (particule cu sarcină electrică pozitivă) din interiorul nucleului unui atom. Numărul atomic este cea mai importantă caracteristică a unui atom, pentru că numărul de protoni dă identitatea unui element chimic. De exemplu, atomul de hidrogen, cel mai simplu atom, are un singur proton. Un atom care are doi protoni se numește heliu. Dacă are trei protoni, vorbim de atomul de litiu, iar dacă are șase, vorbim de carbon.
- Detalii
- de: Iosif A.
- Atomul

Atomii sunt încă, schematic, prezentați în multe publicații după modelul unui sistem solar, cu un nucleu în jurul căruia se rotesc, precum planetele, electronii. Dar înțelegerea modernă a modului în care sunt dispuse și se deplasează particulele elementare care constituie atomul este departe de această schemă.
- Detalii
- de: Iosif A.
- Atomul
