Atomii sunt particule compozite (adică formate din alte particule) foarte mici. Nu-i putem observa cu ochiul liber. Dar aceștia stau la baza materiei din jurul nostru, precum și a celulelor care ne formează corpul.
Dar dacă atomii sunt așa mici, există o cale pentru a calcula, de pildă, câți atomi sunt într-o anumită cantitate de apă?
Fizicianul Carl Zorn oferă o explicație rapidă pentru această problemă, pe care o redăm mai jos:
• Cea mai simplă cale este să cunoaștem două lucruri despre obiectul al cărui număr de atomi vrem să-l aflăm: compoziția chimică și masa.
• Să luăm cazul unui microlitru de apă, care are o masă de 0,001 grame (a mia parte dintr-un gram).
→ Citește și: Cum se măsoară masa unui atom?
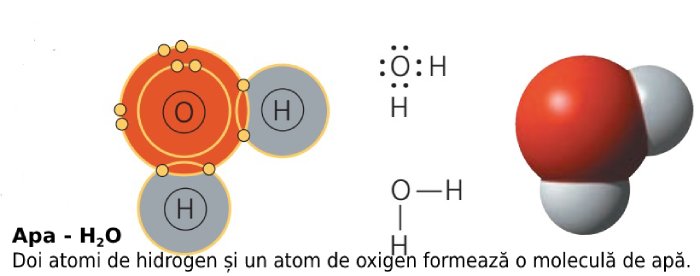
• O moleculă de apă este formată din doi atomi de hidrogen (cel mai ușor atom) și un atom de oxigen.
• Un mol de atomi de hidrogen are o masă de 1 gram, iar un mol de atomi de oxigen are o masă de 16 grame.
• Un mol reprezintă un număr de unități dintr-o substanță chimică, iar unitățile pot fi atomi sau molecule. Numărul de unități care definesc un mol este cunoscut drept numărul lui Avogadro (NA) și are valoarea 6,02x1023.
• Dacă avem un mol de apă, atunci știm că avem o masă de 2 grame (pentru doi moli de atomi de hidrogen), plus 16 grame (pentru un mol de atomi de oxigen), ceea ce face, în total, 18 grame.
• Pentru 0,001 grame de apă, vom avea: NA*(0,001/18)=3,35*1019 molecule de apă. Un număr enorm!
Citește și:
→ Ce este, în fapt, pH-ul unei substanțe? (o explicație la nivel atomic)
→ Care este diferența dintre moleculă, compus chimic și substanță chimică?
Sursa: JLab
