 Un electron de pe cel mai jos nivel energetic într-un atom poate absorbi energia unui foton, energie suficientă pentru a sări pe următorul nivel energetic. În cadrul procesului invers electronul revine pe nivelul energetic anterior, caz în care are loc eliberarea unui foton. Cum se formează liniile spectrale? Citiţi aici (video inclus).
Un electron de pe cel mai jos nivel energetic într-un atom poate absorbi energia unui foton, energie suficientă pentru a sări pe următorul nivel energetic. În cadrul procesului invers electronul revine pe nivelul energetic anterior, caz în care are loc eliberarea unui foton. Cum se formează liniile spectrale? Citiţi aici (video inclus).
Pentru familiarizarea cu tematica abordată în acest articol, citiţi şi:
Logica tabelului lui Mendeleev
Modelul cuantic al atomului
STĂRI EXCITATE ALE ATOMILOR (NIVELURI ENERGETICE)
Electronii care ocupă aceleaşi straturi energetice în cadrul unui atom iau forma unui "nor electronic" ce înconjoară nucleul de dimensiuni mult mai mici. Din moment ce doar 2 electroni pot ocupa un orbital electronic, este interesant de studiat care sunt caracteristicile diverşilor orbitali, respectiv straturi şi niveluri energetice ale atomului.
Aceste stări sunt definite în principal prin intermediul numărului cuantic principal “n” şi, de asemenea, de către numărul cuantic secundar “l”. Iar pentru fiecare stare electronul posedă energii diferite care rezultă din forma norului electronic. Pentru n=1, starea fundamentală, orbitalul are o formă simetrică, aceeaşi în toate direcţiile. Pentru n=2, orbitalul asociat poate avea două forme, în funcţie de valoarea lui "l", ambele cu aceeaşi energie asociată. Una este de nor sferic dublu - o sferă în interiorul alteia. Cealaltă formă a orbitalului corespunzător lui n=2 seamănă cu o halteră. Pentru alte valori ale lui "n" şi "l", formele orbitalilor pot fi foarte stranii, ca de exemplu o combinaţie între o figură toroidală şi o halteră.
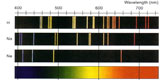
LINIILE SPECTRALE
Un electron aflat pe cel mai de jos nivel energetic într-un atom poate sa intre în contact cu un foton şi să absoarbă energia acestuia, primind astfel energie suficientă pentru a sări pe următorul nivel energetic. Iar în cadrul procesului invers, electronul revine pe nivelul energetic anterior, proces însoţit de eliberarea unui foton. Culoarea fotonului depinde de diferenţa de energie dintre cei doi orbitali.
Astfel se explică apariţia liniilor spectrale asociate fiecărui element chimic.
Din moment ce lumina albă are în componenţă toate culorile spectrului, atunci când un fascicul de lumină albă acţionează asupra unei mostre dintr-un element chimic în condiţii corespunzătoare, atomii acestuia absorb toţi fotonii care le permit electronilor lor să efectueze salturi între orbitali. Astfel că spectrul de absorbţie este dat de toate culorile din componenţa luminii albe, minus acelea care corespund diferenţelor de energie dintre orbitalii atomilor acelui element chimic.
Iar când acei electroni revin în mod spontan pe nivelurile energetice de bază, apar liniile spectrale ale spectrului de emisie, linii corespunzătoare diferenţelor energetice între orbitalii caracteristici acelui element.
Iată un exemplul care evidenţiază spectrul atomului de hidrogen. Numărul cuantic principal "n" este afişat în partea dreaptă alături de linia care reprezintă nivelul energetic.
Atunci când un electron sare de pe nivelul corespunzător lui n=3 pe cel asociat lui n=2, este emis un foton cu frecvenţa corespunzătoare culorii roşu.
Când un electron sare de pe stratul corespunzător lui n=4 pe cel corespunzător lui n=2, este emisă lumină de nuanţa "cyan".
Când un electron sare de pe stratul n=5 pe cel corespunzător lui n=2, este emisă lumină albastră.
La saltul de pe stratul asociat cu n=6 spre cel corespunzător lui n=2, lumina emisă este violetă.
Dacă saltul are loc între straturile energetice corespunzătoare lui n=7, respectiv n=2, este emisă lumină în zona ultravioletă a spectrului.
Nu sunt puse în evidenţă salturi către nivelul energetic corespunzător lui n=1 deoarece toate sunt însoţite de emiterea unor fotoni din zona ultravioletă extremă.
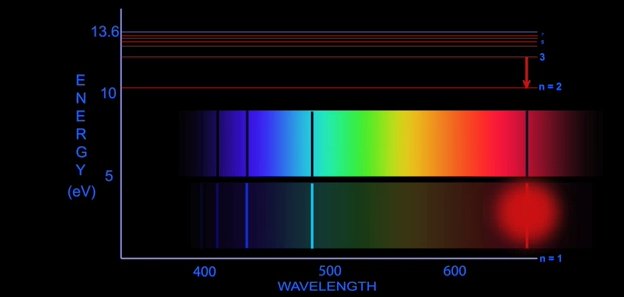
Salt de pe nivelul energetic n=3 spre n=2 însoţit de eliberarea unui "foton roşu"
Notă: articolul de mai sus este reproducerea textului folosit în film.
Traducerea: Scientia.ro.
Credit: www.cassiopeiaproject.com
