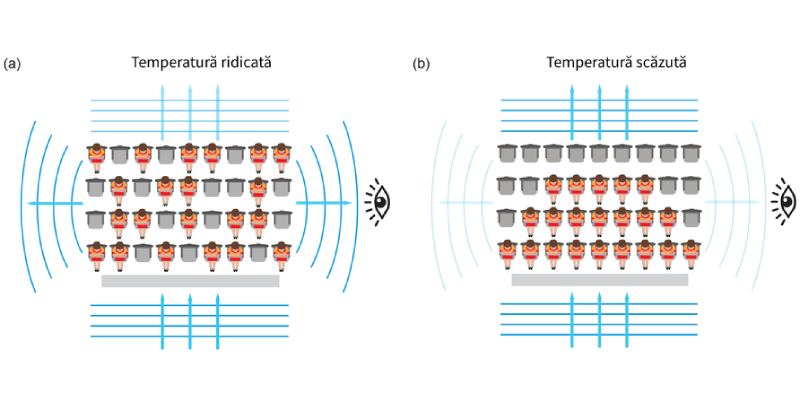
Principiul excluziunii (detalii, mai jos) poate fi ilustrat printr-o analogie implicând oameni ocupând locuri într-o sală de cinema. Fiecare persoană reprezintă un atom, iar fiecare scaun o stare cuantică. La temperaturi ridicate (a), atomii sunt distribuiți aleator, așa că aceștia pot reflecta lumina. La temperaturi scăzute (b), atomii stau strâns grupați, doar cei cu mai mult spațiu, de la marginile grupării de atomi, putând reflecta lumina.
Electronii atomilor sunt distribuiți în jurul nucleului atomic în cadrul unor straturi energetice. Principiul excluziunii al lui Pauli are o importanță fundamentală în stabilirea distribuției electronilor. Detalii privind regulile acestei distribuții puteți citi aici.
Recent, fizicieni de la MIT au observat că principiul excluziunii poate afecta modul în care nori de atomi reflectă lumina. Ipoteza fusese avansată în urmă cu 30 de ani, dar este pentru prima oară când aceasta a fost demonstrată experimental.
În mod normal, atunci când fotonii pătrund în norul de atomi, aceștia sunt dispersați (reflectați) în diverse direcții în urma interacțiunii cu atomii. Electronii atomilor sar de un strat energetic pe cel superior în urma absorbției unui foton (energie), revenind rapid pe stratul anterior, fenomen însoțit de eliberarea de fotoni.
Dar când norul de atomi este răcit și comprimat, principiul excluziunii interzice reflectarea fotonilor în bună măsură. Dacă materia nu reflectă lumina, atunci nu este vizibilă. De exemplu, credem că materia întunecată are exact această proprietate: nu reflectă lumina. În experimentele efectuate fizicienii au folosit atomi de litiu.
Am tot menționat principiul excluziunii. Ce este acesta?
Principiul excluziunii al lui Pauli
Principiul excluziunii, formulat de Wolfgang Pauli în 1925, afirmă că în învelişul electronic al unui atom nu pot exista doi electroni cu aceleaşi patru numere cuantice în acelaşi timp. Aşadar, pentru doi electroni identici, dacă numerele cuantice n, l şi ml sunt identice, ms, spinul, trebuie să fie diferit.
Funcţia de undă a unui electron este descrisă ca un set de patru numere cuantice: numărul cuantic principal <n>, numărul cuantic unghiular (secundar) <l>, numărul cuantic magnetic <ml> și spinul <ms>.
• Numărul cuantic principal, n, descrie apartenenţa unui electron la un anumit nivel energetic. Poate lua valori de la 1 la infinit. Odată cu creşterea numărul cuantic principal, creşte şi energia electronului, iar orbitalii ocupă un spaţiu mai mare.
• Numărul cuantic secundar, l: acesta descrie apartenenţa electronilor la un anumit subnivel energetic.
• Numărul cuantic magnetic, ml: descrie orientarea spaţială a orbitalilor; care identifică orbitalii în cadrul substraturilor, iar fiecare valoare a lui ml corespunde uneia din orientările permise pentru câmpul magnetic asociat orbitalului.
• Numărul cuantic de spin, ms: descrie impulsul propriu de rotaţie al electronilor şi poate avea valorile +1/2 sau -1/2. Pe un orbital încap maxim 2 electroni, primul ocupant fiind de spin paralel (+1/2), iar al doilea, în mod obligatoriu, de spin opus.
Distribuirea electronilor în învelişul electronic respectă trei principii: principiul excluziunii al lui Pauli, principiul energetic şi regula lui Hund. Pentru detalii, citiți: Cum sunt distribuiți electronii în cadrul atomului.
Dar principiul excluziunii nu se aplică doar electronilor?
Fizicienii au descoperit că, în fapt, principiul excluziunii guvernează nu doar comportamentul electronilor, ci și al unei întregi clase de particule denumite fermioni (quarcuri, electroni, miuoni, tauoni și neutrini - particule cu spinul 1/2), incluzând, prin extensie, protonii, neutronii și multe tipuri de atomi. Ca efect, fermionii se pot respinge fără a interacționa direct.
Pentru a ne întoarce la experimentul nostru, dat fiind aranjamentul stabilit de cercetători, atomii nu pot avea aceeași stare cuantică. Fiind comprimați într-un nor dens și răciți aproape de zero absolut, aceștia vor fi în stările cuantice fundamentale (de cea mai joasă energie). În acest aranjament, atomii nu pot fi excitați de fotoni (nu-și pot schimba starea cuantică), prin urmare nu vor absorbi și elibera fotoni. Asta înseamnă că doar o mică parte din atomi vor reflecta fotoni, ceea ce înseamnă că norul de fotoni devine în bună parte transparent. Căci dacă fotonii nu sunt reflectați, aceștia trec mai departe, iar norul este mult mai puțin vizibil, de vreme ce vizibilitatea unui lucru înseamnă capacitatea acestui lucru de a reflecta lumina.
Această tehnică de a controla vizibilitatea atomilor poate avea aplicații în diverse zone ale tehnologiei. De exemplu, procesul de dispersie (reflectare) a luminii este strâns legat de emisia spontană, în care un atom aflat într-o stare de mare energie trece într-o stare de energie scăzută, emițând fotoni. Această trecere la o stare inferioară energetic ar putea fi blocată, lungind perioada în care atomii se păstrează într-o stare energetică. Această tehnică ar putea fi utilă pentru stocarea informației cuantice pentru perioade mai lungi decât este posibil în prezent.
Sursa: MIT (imagine) și ScienceNews
