Hidrogenul este elementul chimic în tabelul periodic al elementelor cu simbolul H și numărul atomic 1. Este un gaz ușor inflamabil, incolor, insipid, inodor, iar în natură se întâlnește mai ales sub formă de moleculă diatomică, H2. Hidrogenul este cel mai ușor element chimic.
Hidrogenul elementar are o pondere de 75% din masa universului. În starea de plasmă, se găsește ca element majoritar în alcătuirea stelelor. Hidrogenul elementar este foarte puțin răspândit pe Pământ.
Pentru necesități industriale există diferite procedee de fabricație. De exemplu, hidrogenul poate fi obținut prin electroliza apei (separarea atomilor de oxigen și hidrogen).
Cel mai răspândit izotop al hidrogenului este protiul, care este alcătuit dintr-un proton în nucleu și un electron în învelișul electronic. În compușii ionici poate avea sarcină negativă (anion cunoscut sub numele de hidrură, H-) sau sarcină pozitivă H+ (hidron).
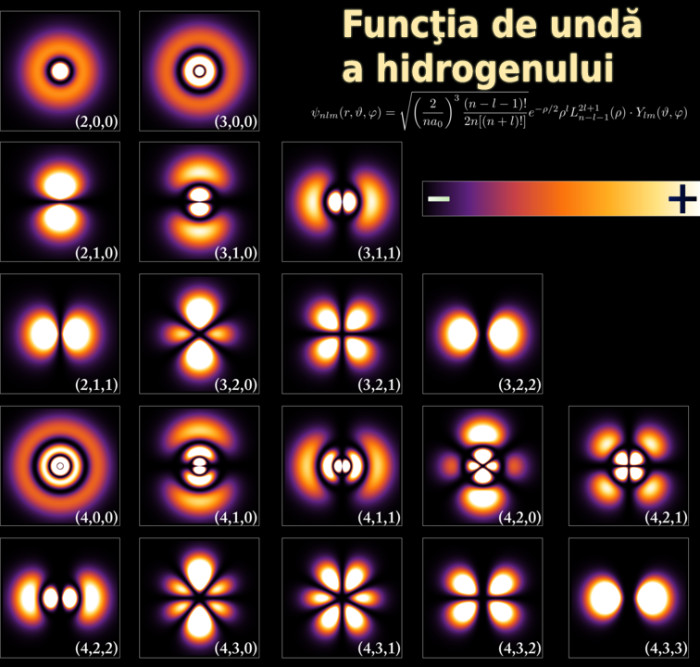
Hidrogenul este singurul atom pentru care soluția analitică a ecuației lui Schrödinger este pe deplin cunoscută, având un rol important în fundamentarea teoriei mecanicii cuantice.
Hidrogenul este un gaz puternic reactiv și își găsește aplicații în industrie. Hidrogenul se folosește în industria petrochimică la producerea benzinelor, în industria chimico-alimentară pentru hidrogenarea grăsimilor (de exemplu producerea margarinei), în prelucrările mecanice ale metalelor și în tratamentul termic al acestora.
Hidrogenul reprezintă o alternativă pentru înlocuirea benzinei drept combustibil pentru vehiculele echipate cu motoare cu ardere internă. Avantajele sale principale constau în faptul că este ecologic, din arderea sa rezultând vapori de apă, iar randamentul termic al motoarelor cu hidrogen este ridicat. Dezavantajele constau în pericolul mare de explozie, dificultatea stocării în vehicul și lipsa unor rețele de stații de alimentare cu hidrogen. Una dintre cele mai promițătoare soluții tehnice o reprezintă conversia directă a energiei chimice din hidrogen în electricitate, prin intermediul pilelor de combustie.
În anul 2019 a fost descoperită ceea ce a fost numită „prima moleculă formată în univers”, formată la cca 300.000 ani după Big Bang, hidrura de heliu (HeH+) (eng. „helium hydride ion”). Este o combinație între un atom de heliu și un proton (fără electroni) de hidrogen. Descoperirea s-a făcut ajutorul observatorului astronomic SOFIA (Stratospheric Observatory for Infrared Astronomy, plasat în stratosferă, un proiect comun germano-american) în nebuloasa planetară NGC 7027.
Cum a fost descoperit hidrogenul
Hidrogenul a fost descoperit de către chimistul și fizicianul englez Henry Cavendish în 1766, în urma unui experiment în care a studiat reacțiile dintre mercur și acid. Când a amestecat cele două substanțe, a observat apariția unor mici bule de gaz în amestec. Acest aspect l-a determinat să efectueze o cercetare suplimentară, numind substanța necunoscută „aer inflamabil”. În 1781 a descoperit că acest element produce apă atunci când arde.
O analiză mai detaliată a fost efectuată de către Antoine Lavoisier, care descoperă gazul independent de Cavendish în urma unui experiment ce urmărea determinarea masei pierdute sau create în urma unei reacții chimice. Cercetătorul a încălzit apa într-un recipient închis, vaporii formați condensându-i într-un alt recipient. Cantitatea pierdută a fost atribuită degajării unui gaz (H2). Chimistul francez a observat că „aerul inflamabil” al lui Cavendish în combinație cu oxigenul formează picături de apă. Lavoisier a numit gazul „hidrogen” (din greacă, unde hydro înseamnă apă, iar gignomai înseamnă a naște, a crea).
Răspândirea în Univers și pe Pământ
Hidrogenul este cel mai răspândit element în univers, reprezentând mai mult de 75% în masă și mai mult de 90% după numărul de atomi. Se găsește în cantități mari în compoziția stelelor și a planetelor gigantice gazoase. Norii moleculari de H2 sunt asociați cu formarea stelelor. Hidrogenul joacă un rol-cheie și în exploziile stelare datorate reacțiilor de fuziune nucleară dintre protoni.
În Univers, hidrogenul este întâlnit mai ales sub forma de atomi și în stare de plasmă. Proprietățile acestora sunt diferite față de cele ale moleculei de hidrogen. Electronul și protonul de hidrogen nu formează legături în starea de plasmă, din cauza conductivității electrice diferite și a unei emisii radiative mari (originea luminii emise de Soare și alte stele). Particulele încărcate cu sarcini electrice sunt puternic influențate de câmpurile magnetice și electrice. De exemplu, în vânturile solare particulele interacționează cu magnetosfera terestră, generând curenți Birkeland și produc fenomenul cunoscut sub denumirea de auroră boreală. Hidrogenul se găsește în stare atomică neutră în mediul interstelar.
În condiții normale, hidrogenul există pe Pământ sub formă de moleculă diatomică, H2, însă nu este foarte răspândit în atmosfera terestră (în concentrație medie de 1 ppm de volum) din cauza masei mici, forța gravitațională a planetei are un efect foarte slab asupra sa. Totuși, hidrogenul (prin compușii săi) este cel mai răspândit element de la suprafața Terrei. Cei mai întâlniți compuși chimici ai săi sunt hidrocarburile și apa. Hidrogenul gazos este produs de anumite specii de bacterii și alge. Metanul este o importantă sursă de hidrogen.
Atomul de hidrogen
Nivelurile energetice ale atomului de hidrogen
Nivelul energetic fundamental al electronului în atomul de hidrogen are energia egală cu -13,6 eV. Nivelurile superioare se numesc nivele excitate, energia acestora crescând până la 0 eV (valoarea nivelului energetic aflat la infinit).
Niels Bohr, unul dintre figurile centrale în fundamentarea mecanicii cuantice, considera că nucleul atomului este fix, iar electronul are o traiectorie circulară în jurul acestuia, asemănătoare cu planetele ce gravitează în jurul Soarelui. Forța electromagnetică atrage electronul și protonul unul spre celălalt, aşa cum corpurile cerești se atrag datorită gravitației. Potrivit condiției de cuantificare a momentului cinetic postulat de Bohr, valoarea momentului cinetic al electronului este multiplu întreg al constantei reduse al lui Planck, de unde rezultă că în cadrul atomului electronului îi sunt permise doar anumite orbite cu raze bine stabilite. Această relație de cuantificare explică spectrul discret al nivelelor energetice.
O descriere mai exactă a atomului de hidrogen este dată în fizica cuantică unde se calculează densitatea de probabilitate cu ajutorul funcției de undă a electronului în jurul protonului, pe baza ecuației lui Schrödinger.
· Citește și: De ce nu cade electronul în nucleul atomic?
Izotopii hidrogenului
Hidrogenul are trei izotopi naturali, 1H, 2H și 3H. Alții, ce au nucleele foarte instabile (4H până la 7H), au fost creați în laborator, dar nu au fost observați în natură.
1H este cel mai răspândit izotop al hidrogenului, având o pondere de peste 99,98% în compoziția izotopică naturală al acestui element. Datorită faptului că acesta are în nucleul un singur proton, a fost numit protiu, această denumire fiind însă rar utilizată.
2H, celalalt izotop stabil al hidrogenului, este cunoscut și sub numele de deuteriu. Conține în nucleu un proton și un neutron, acest izotop fiind generat imediat după nașterea universului (Big Bang), continuând să existe până acum datorită stabilității sale. Nu este radioactiv.
Apa ce este bogată în dioxid de deuteriu se mai numește și apă grea. Deuteriul și compușii săi sunt utilizați ca etalon în experimente neradioactive și ca solvent în procedeele de spectroscopie RMN. Apa grea este utilizată ca moderator de neutron și ca lichid de răcire pentru reactoarele nucleare. Deuteriul este de asemenea folosit drept combustibil pentru fuziune nucleară.
3H se mai numește și tritiu; conține în nucleu un proton și doi neutroni. Este radioactiv, rezultând din izotopul Heliu-3 prin dezintegrarea beta și are un timp de înjumătățire de 12,32 ani. Cantități mici din acest izotop sunt răspândite și în natură, acesta rezultând din interacțiunea razelor cosmice cu gazele atmosferice; tritiul este eliberat și în timpul testelor nucleare. Este folosit și în reacții de fuziune nucleară și pentru evidențierea și studiul de geochimia izotopilor și în dispozitive autogeneratoare de lumină. Tritiul se mai utilizează și în marcarea radioizotopică, în special în domeniul biologiei, medicinei sau geologiei. Dioxidul de tritiu se mai numește și apă supergrea.
Hidrogenul este singurul element care are nume diferite pentru izotopii săi cei mai răspândiți.
Hidrogenul metalic
În general, hidrogenul este considerat drept un nemetal, însă la temperaturi joase și la presiuni mari unele din proprietățile sale se aseamănă cu cele ale metalelor. Hidrogenul metalic a fost obținut pentru prima oară în 1973 la o presiune de 2,8 Mbar și la 20 K. Aliajul SiH4 cu structură metalică a fost obținut în 2008, descoperindu-se că este un foarte bun conductor electric, în conformitate cu predicțiile anterioare ale lui lui N. W. Ashcroft. În acest compus, chiar și la presiuni moderate, hidrogenul are o structură cu o densitate ce corespunde cu cea a hidrogenului metalic.
Utilizarea hidrogenului
Anual consumul mondial de hidrogen se cifrează la peste 500 miliarde metri cub în diverse scopuri și în diferite domenii, a căror varietate și necesități sunt în creștere pe măsura scăderii resurselor de combustibili fosili și schimbărilor climatice datorate creșterii emisiunii de CO2 în atmosferă. Pentru a putea asigura accesul diferiților consumatori la sursele de hidrogen este necesară dezvoltarea unei infrastructuri adecvate.
Gaz de umplere pentru baloane
Una din primele utilizări ale hidrogenului a fost în cazul baloanelor. Inițial a fost utilizat de Jacques Alexandre César Charles în 1783 pentru un zbor de 45 minute. Primele dirijabile au fost umplute cu hidrogen. Datorită inflamabilității ușoare, s-au produs însă nenumărate accidente (catastrofa dirijabilelor Dixmude în 1923 și Hindenburg în 1937) și a fost înlocuit de heliu. Datorită densității mici, baloanele umplute cu hidrogen au o forță ascensională mare. Astfel se pretează foarte bine la utilizarea și în prezent în cazul baloanelor meteorologice, de transport și de publicitate.
Sudură
Pe lângă sudarea oxiacetilenică, la sudarea cu gaz (tot mai rar utilizată, temperatura flăcării cca. 3100°C) se poate utiliza energia de ardere a hidrogenului în locul acetilenei. De fapt pentru prima dată în anii 1838/40 francezul Desbassayns de Richmont a reușit să sudeze cu o flacără de hidrogen două plăci de plumb. La sudura cu arc cu hidrogen atomic se utilizează energia de recombinare a hidrogenului atomic în hidrogen molecular rezultând în punctul de sudare o temperatură de până la 4000°C. La sudură în mediu cu gaz inert, hidrogenul este utilizat și în componența gazului de protecție.
Combustibil pentru rachete
În tehnica spațială hidrogenul lichid este un combustibil obișnuit pentru motoarele criogenice ale rachetelor, fiind stocat în rezervorul de combustibil al rachetei de lansare a navetelor spațiale americane. În aceste motoare hidrogenul lichid este folosit întâi la răcirea ajutajului și a altor părți ale motorului, înainte de a fi amestecat cu oxidantul, de obicei oxigenul lichid (LOX), și apoi ars. Din ardere rezultă apă, ozon și apă oxigenată.
Combustibil pentru avioane cu reacție
În tehnica aeronautică, primul motor cu reacție construit de firma Heinkel HeS 1 în 1937 – a funcționat având ca și combustibil hidrogen. Actualmente sunt dezvoltate motoare cu reacție ce pot funcționa pe bază de hidrogen, dar deocamdată nu sunt în exploatare datorită masei mari a rezervoarelor, ce intră în contradicție cu necesitățile privind greutatea proprie a avioanelor. În anul 1988 avionul TU – 156 variantă a TU –154, având toate cele trei motoare modificate, a zburat cu succes pe alimentare cu hidrogen stocat sub stare de agregare lichidă. Airbus are un proiect de construcție Cryoplane cu participarea a 36 firme pentru a evalua posibilitatea realizării unui avion cu hidrogen lichid.
Combustibil pentru motoare cu ardere internă
Motoarele cu ardere internă pot fi adaptate pentru a utiliza hidrogen lichid drept combustibil. BMW H2R ("Hydrogen Record Car") cu o putere de 210kW (232CP) a atins 300km/h. Hydrogen 7 al aceleiași firme este construit cu un motor de 260 kW, 229 km/h și 0 - 100km/h in 9.5 sec. Cu posibilitate dublă de alimentare benzină și hidrogen. Acest lucru s-a realizat prin montarea unui rezervor de hidrogen lichid ceea ce a redus capacitatea compartimentului de bagaje de la 500 la 250 l. Hidrogenul înmagazinat permite o autonomie de 200km, dar la neutilizare în decurs de 9 zile se reduce la o cantitate suficientă pentru parcurgerea a 20 km. Mazda a echipat modelul său RX-8 cu motor Wankel (piston rotativ) ce funcționează cu combustibil hibrid benzină sau hidrogen dezvoltând 184 kW (255 hp).
Avantajele utilizării hidrogenului la motoarele cu ardere internă:
· Puterea litrică a motorului crește cu 10-15% față de cazul utilizării benzinei, dacă hidrogenul se introduce direct în cilindri.
· Se reduce funcționarea dură a motorului datorită vitezei mai mici de creștere a presiunii, prin intermediul propagării frontului de flacără și a formei camerei de ardere.
· Sarcina motorului se reduce calitativ, conducând la obținerea unor randamente mai mari la sarcini parțiale decât la folosirea benzinei.
· Se reduc destul de mult emisiile poluante prin dispariția totală a oxidului de carbon, a particulelor solide și a hidrocarburilor nearse.
Combustibil în pile de combustie
Pilele de combustie sunt dispozitive de conversie electrochimică ce produc energiei electrică utilizând drept combustibil hidrogenul, metanul, metanolul, soluția de glucoză, iar ca oxidant oxigenul, clorul, bioxidul de clor, peroxidul de hidrogen etc. Randamentul ajunge până la de 72% pe celulă (62% pe sistem) în funcție de tip, energia netransformată în curent electric este disipată sub formă de căldură.
Pilele de combustie se utilizează în:
- Mijloace de transport
· 37 autobuse fabricate de firma Mercedes-Benz sunt în exploatare în 9 orașe europene în cadrul proiectului Clean Urban Transport for Europe
· 20 autoturisme tip Honda FCX sunt în circulație având rezervoare de hidrogen în care încap max. 4 kg hidrogen ce asigură 300km autonomie la o viteză de max. 150km/h și o putere de 80kW (107CP)
· Firma Boeing are un proiect de utilizarea hidrogenului stocat sub formă gazoasă ce este utilizat în pile de combustie ce produc electricitate pentru electromotorul de acționare a avionului.
- Aparate portabile
Ca sursă de energie electrică sub formă de pilă de combustie miniaturală poate înlocui acumulatoarele în aparatele portabile. Tehnologia stocării hidrogenului în cantități mici nu este pusă la punct.
- Centrale pentru clădiri
Pilele de combustie pot fi utilizate pentru generarea de curent electric, iar căldura disipată (până la 50% din energia înmagazinată în hidrogen) pentru încălzire și prepararea apei calde.
Combustibil în centrale nucleare pe bază de fuziune
În proiectul JET cu ajutorul camerei toroidale Tokamak s-a realizat la 9 noiembrie 1991 prima reacție de fuziune cu un amestec de 86:14 deuterium-tritium, iar în anul 1998 s-a atins un Q=0,7 la un vârf de 16MW pe o durată mai scurtă de o secundă.
Într-un tokamak, nucleii sunt prinşi în mijlocul unui cîmp magnetic de formă toroidală (vezi figura). Această formă a camerei reactorului împiedică particulele să scape din câmpul magnetic, readucându-le “în mijlocul acţiunii” atunci când au tendinţa să scape câmpului magnetic.
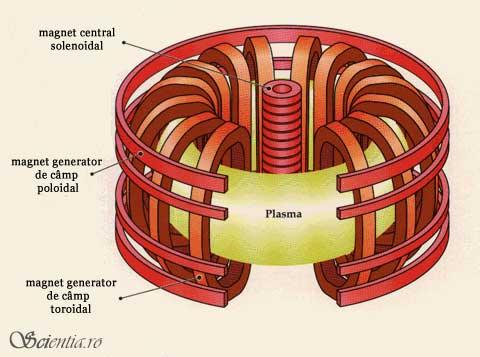
ITER constituie un proiect mai avansat care a fost lansat în noiembrie 2006, odată cu semnarea tratatului de colaborare de către 7 state pentru realizare primului reactor de test în Cadarache.
Materie primă în procesul de reducere a minereurilor
Hidrogenul poate reacționa cu oxizii metalelor preluând oxigenul din aceștia. Va rezulta apă și metalul al cărui oxid a intrat în reacție. Acest procedeu este utilizat în industria metalurgică pentru a obține metale cu o puritate mai ridicată.
Materie primă în procesul de fabricare a amoniacului
În procedeul Haber-Bosch din gaz metan, prin reformare în trei faze, se obține hidrogen care mai apoi reacționează cu azotul din aer la o presiune de 300 bar și o temperatură de 450°C. Rezultă amoniac utilizat la fabricarea îngrășămintelor și explozivilor. Datorită temperaturii și presiunii mari, fabricarea amoniacului necesită un consum de energie ce reprezintă 1,1% din producția mondială.
Materie primă în procesul de hidrogenare
Prin hidrogenare, în uleiurile vegetale, se saturează legăturile duble din moleculele acizilor grași cu hidrogen. Procesul are loc în prezența catalizatorului din nichel la 120-180 °C și o presiune de 6-7 bar. Moleculele rezultate au un punct de topire mai înalt și ca urmare produsul rezultat (margarina) devine consistentă la temperatura camerei.
Material sintetic
Prin hidrogenare materialele sintetice se sparg în componente mai mici rezultând produse gazoase și lichide uleioase. În acest scop materialele sintetice se mărunțesc, se spală și la 500 °C, sub presiune, cu ajutorul hidrogenului vor fi transformate. Gazele rezultate vor putea fi utilizate ca și combustibil, cu mențiunea că vor rezulta mai puține reziduuri toxice decât în cazul arderii directe a deșeurilor.
Agent de răcire
Datorită capacității termice mari, hidrogenul este utilizat în centrale și instalații industriale ca agent de răcire. De obicei se utilizează H2 în cazurile în care nu se poate apela la lichide. Avantajul capacității mari se evidențiază în cazurile când viteza de circulație a gazului se cere a fi redusă sau nulă. Deoarece hidrogenul prezintă și o bună conductibilitate termică, se pot utiliza curenți de hidrogen pentru transportul căldurii în rezervoare mari. În astfel de aplicații hidrogenul apără instalațiile de supraîncălzire și mărește eficiența.
Criogenie
Hidrogenul lichid având o capacitate termică foarte mare se poate utiliza ca agent de răcire pentru temperaturi foarte mici necesare în cazul supraconductorilor, a distilării criogenice, conservării celulelor și organelor, intervențiilor chirurgicale criogenice. Hidrogenul lichid poate absorbi mari cantități de căldură înainte ca să se observe o variație semnificativă de temperatură rezultând o stabilitate mare chiar și la oscilații mari ale temperaturii exterioare.
Aspecte de securitate și sănătate
Hidrogenul poate forma amestecuri explozive cu aerul și reacționează violent cu oxidanții. În cazul inhalării în cantități foarte mari, poate produce asfixierea, pierderea mobilității motrice și a cunoștinței. Scurgerea hidrogenului gazos în atmosferă poate cauza autoaprinderea sa. Flacăra de hidrogen este invizibilă, acest lucru putând produce arsuri accidentale.
Sursa: wikipedia.org
