 Alcanii sunt hidrocarburile în care nu apar decât legături simple de tipul C─C si C─H şi la care raportul numeric dintre cele două tipuri de atomi este exprimat prin formula CnH2n+2, unde n reprezintă numărul atomilor de carbon. În continuare, detalii despre alcani.
Alcanii sunt hidrocarburile în care nu apar decât legături simple de tipul C─C si C─H şi la care raportul numeric dintre cele două tipuri de atomi este exprimat prin formula CnH2n+2, unde n reprezintă numărul atomilor de carbon. În continuare, detalii despre alcani.
Introducere în chimia organică
Denumirea alcanilor
Dacă i se dau lui n valori naturale succesive (şirul natural al numerelor) se obţine seria omoloagă a alcanilor. Numele alcanilor se formează după regulă, cu excepţia primilor patru termeni care au denumiri specifice.
n=1 CH4 metan CH4
n=2 C2H6 etan CH3─CH3
n=3 C3H8 propan CH3─CH2─CH3
n=4 C4H10 butan CH3─CH2─CH2─CH3
n=5 C5H12 pentan CH3─CH2─CH2─CH2─CH3
n=6 C6H14 hexan CH3─CH2─CH2─CH2─CH2─CH3
Toţi aceşti alcani au catene liniare. La alcanii cu patru atomi de carbon sau mai mulţi poate apărea ramificarea lanţului. De aceea, denumirea alcanilor liniari este completată cu prefixul normal iar denumirea alcanilor ramificaţi se completează cu prefixul "izo". Cicloalcanii sunt hidrocarburi ciclice saturate care conţin o catenă ciclică şi au formula generală CnH2n. Dacă din molecula unui alcan se îndepărtează un atom de hidrogen rezultă un radical alchil.
CH3─ (metil) ; ─CH2─ (metilen) ; ─CH─ (metin)
CH3─CH2─CH2─ (propil)
Izomeri de catenă
Atomii din catenele de metan, etan, propan, nu se pot aranja decât în câte un singur mod. Pentru butan există două modalităţi:
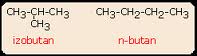
Aceştia sunt izomeri de catenă.
Numărul de izomeri de catenă creşte odată cu numărul atomilor de carbon din moleculă. Este foarte important de reţinut că toţi izomerii unei substanţe au aceeaşi formulă moleculară dar sunt substanţe chimice diferite.
Izomerii de catenă ai alcanilor se denumesc după următoarea regulă:
- se stabileşte cea mai lungă catenă liniară;
- se numerotează de la un capăt atomii de C astfel încât catena laterală să ocupe poziţia cu numărul cel mai mic;
- se denumesc radicalii catenelor laterale şi se indică poziţia lor prin cifre;
- citirea radicalilor se face în ordine alfabetică (etilul înaintea metilului);
- dacă sunt mai mulţi radicali identici se folosesc prefixe: di-, tri-, etc;
Atomii de carbon ai alcanilor sunt hibridizaţi sp3, ceea ce determină un unghi dintre covalenţe de 109,5 grade şi o lungime a legăturilor C-C de 1,54 A.
Principalele surse de alcani sunt gazele naturale şi petrolul. Gazele naturale pot fi formate din metan (zăcăminte de gaz metan) sau gaze de sondă (gaze de petrol) care conţin alcani de la C1 la C5.
Proprietăţi fizice
Punctele de topire şi fierbere ale alcanilor cresc odată cu creşterea numărului de atomi de carbon. Ramificarea determină micşorarea punctului de fierbere. Alcanii de la C1 până la C4 sunt gazoşi, cei de la C4 până la C15 sunt lichizi iar alcanii superiori sunt solizi. Deoarece alcanii gazoşi nu au miros, pentru depistarea scăpărilor de gaze din conducte şi de la aragaz se folosesc compuşi cu miros respingător, de avertizare, numiţi mercaptani.
Proprietăţi chimice
Denumirea de parafine provine de la „parum affinis”- afinitate (chimică) mică, adică au reactivitate chimică scăzută. Reacţiile chimice la care participă alcanii se grupează după natura legăturilor covalente care se desfac(legăturile C─H se desfac la substituţie, dehidrogenare, oxidare; legăturile C─C se desfac la descompunere termică, izomerizare, ardere).
1. Reacţiile de substituţie
Halogenarea:→ derivaţi halogenaţi
R─H + X2 → R─X + HX
2. Reacţiile de izomerizare au loc la temperatura de 50 - 100°C sub acţiunea unor catalizatori ca bromura sau clorura de aluminiu anhidră. Această reacţie a fost descoperită de chimistul român C.D. Neniţescu.
3. Reacţiile de oxidare sunt reacţiile care au loc în prezenţa oxigenului. Acestea pot fi: oxidări incomplete şi oxidări totale (arderi).
Oxidări incomplete ale metanului:
CH4 + 1/2O2 → CH3OH (metanol) la 60 atm şi 400°C
CH4 + O2 → CH2O (aldehida formica) + H2O catalizatori oxizi de azot, 400-600°C
2CH4 + O2 → 2CO + 4H2(gaz de sinteză)
Arderi: Oxidarea totala a alcanilor conduce la formarea dioxidului de carbon şi a apei, cu degajare de căldură. Aceasta explică folosirea unor alcani ca şi combustibili.
CH4 + 2O2 → CO2 + 2H2O + Q(căldură)
4. Descompunerea termică a alcanilor
Alcanii prezintă stabilitate termică ridicată (la temperaturi mai mici are loc cracarea acestora,iar la temperaturi mai mari de de 650°C are loc dehidrogenarea).
Cracare
CH3─CH2─CH2─CH3 → CH4 (metan) + CH2═CH─CH3 (propena)
→ CH3─CH3 (etan) + CH2═CH2 (etena)
Dehidrogenare
CH3─CH2─CH2─CH3 → CH2═CH─CH2─CH3 (1-butenă)+ H2{jcomments on}
→ CH3─CH═CH─CH3 (2-butenă)+ H2
Bibliografie: manualele alternative de chimie pentru clasa a X-a.
