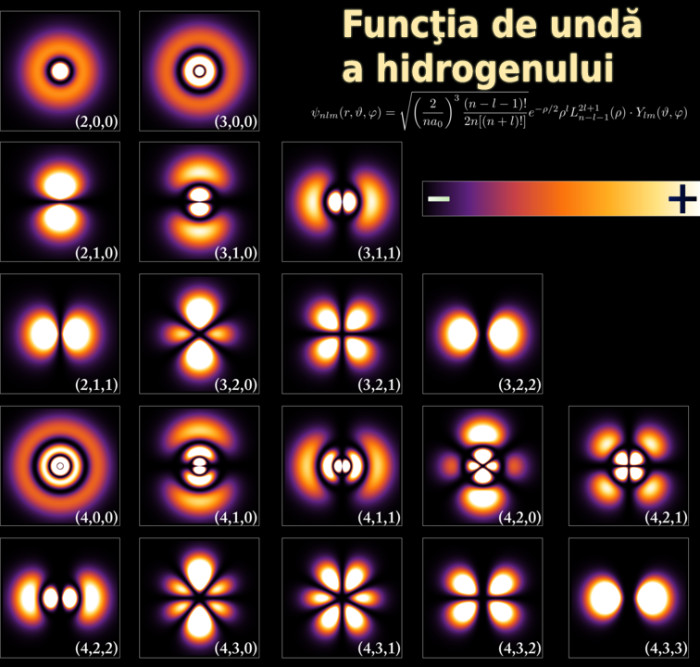
Orbitalii atomici ai electronului în atomul de hidrogen, la energii diferite. Probabilitatea de a găsi electronul este dată de culoare (cu cât mai strălucitoare, cu atât mai mare probabilitatea). Credit: wikipedia.org
Să luăm atomul cel mai simplu, atomul de hidrogen, alcătuit dintr-un proton (sarcină pozitivă) şi dintr-un electron (sarcină negativă), ultimul aflându-se în mişcare în jurul nucleului atomic. Atracţia electrică dintre cele două particule (sarcinile de semne opuse, "+" şi "-", se atrag) face ca electronul să se mişte circular în jurul nucleului, asemănător modului în care Pământul se mişcă în jurul Soarelui. Dar această descriere a deplasării electronului are o problemă gravă...
Conform teoriei electromagnetismului creată de fizicianul scoţian James Clerk Maxwell, o sarcină electrică, precum electronul, deplasându-se pe o traiectorie care nu e o linie dreaptă va pierde pierde energie sub forma de unde electromagnetice. O consecinţă a acestei pierderi de energie este imposibilitatea de a se mai opune atracţiei electrice şi căderea electronului în nucleu. Procesul ar fi extrem de rapid, practic într-o fracţiune de secundă electronul şi-ar pierde întreaga energie, iar atomii de hidrogen nu ar putea exista, iar lectura acestuia articol nu ar fi posibilă...
Salvarea situaţiei vine de la mecanica cuantică, dar înțelegerea exactă a fenomenului este destul de contraintuitivă.... Nu e singurul caz, atunci când vorbim despre mecanica cuantică, dar, înainte de a vorbi despre modul în care atomul se păstrează stabil, este nevoie de o scurtă introducere în teoria cuantică.
· Funcţia de undă
În mecanica cuantică particulele elementare nu sunt... particule, adică nu mai sunt înţelese ca sfere rigide (tip biliard) ori puncte geometrice, ca în fizica clasică. O particulă corespunde unei funcţii de undă: un obiect difuz şi întins în spaţiu, din cauza caracterului său de undă. În videoclipul de mai jos puteţi vedea o explicaţie vizuală a acestui subiect destul de complicat.
Vizualizarea funcţiei de undă
Funcţia de undă nu are limite bine definite; acestea se întind mult dincolo de locul care ar corespunde poziţiei unei particule. De aici decurg multe fenomene contraintuitive.
De exemplu, interacţiunea dintre particule. Când ne gândim la ciocnirea dintre două particule, lucrurile par relativ simple, căci le considerăm două bile care se lovesc una de alta. Dar dacă vorbim de funcţii de undă, cine se ciocneşte cu cine? Dat fiind că funcţiile de undă au o întindere mare, asta înseamnă că două funcţii de undă se pot influenţa reciproc şi atunci când nu se află în proximitate spaţială.
Obiectelor cuantice, descrise prin funcţii de undă, nu li se pot atribui poziţii şi viteze precise (principiul incertitudinii a lui Heisenberg). Măsurătorile nu pot fi îmbunătăţite prin teorii/tehnologii mai bune; această incertitudine este intrinsecă naturii.
Înălţimea funcţiei de undă într-un anumit punct ne dă probabilitatea, mai mare sau mai mică, de a găsi particula în acel punct. Este de menţionat că, şi aceasta este un aspect important al mecanicii cuantice, actul măsurării unei particule duce la colapsarea funcţiei de undă. Ce înseamnă asta? Că existenţa probabilă a particulei într-o anumită zonă devine certă abia în momentul măsurării. Este ca şi cum particula nu ar avea nicio poziţie până nu este măsurată (se află într-o stare de "superpoziţie").
Funcţia de undă nu reprezintă un obiect fizic observabil în toate detaliile sale, ci o descriere matematică a tuturor proprietăţilor accesibile. Dar funcţia de undă are consecinţe importante pentru atomi, pentru că aceasta face ca atomul să poată avea doar stări energetice bine precizate, infinit de multe.
Unde se află electronii?
· Deci, de ce nu cad electronii în nucleul atomic?
Un electron are o funcţie de undă sferică, cu o lungime de undă fixată, care înconjoară nucleul atomic. Felul în care se ajunge la un set discret de energii poate fi vizualizat în videoclipul de mai jos (minutul 3:20), care analizează contribuţia fizicianului francez Louis de Broglie la teoria atomică.
Cu cât viteza electronului este mai mare, cu atât unda va oscila mai repede, cu atât lungimea de undă mai mică. Pentru ca funcţia de undă să nu dispară, o creastă a undei trebuie să cadă exact peste poziţia ei iniţială. Prin urmare, un electron trebuie să se deplaseze cu o viteză dată, pentru a nu distruge funcţia de undă.
Acum să menţionăm şi proprietăţile forţelor care menţin electronul pe orbita circulară în jurul nucleului, căci aceste forţe ne spun cum e accelerat şi încetinit electronul. Pentru mişcarea de-a lungul cercului trebuie să existe un echilibru între forţa exercitată de nucleu, care atrage electronul, şi tendinţa electronului de a se deplasa în linie dreaptă. Circumferinţa trebuie să fie multiplu întreg al lungimii de undă, ceea ce face ca electronul să se poată deplasa doar pe cercuri cu raze bine determinate, adică pe orbite "permise", unde funcţia de undă nu este nenulă.
Energiile electronilor sunt strict legate de orbitele acestora; energiile acestora trebuie să fie discrete (cu anumite valori), iar mărimea acestor energii trebuie să menţină suprapunerea crestelor orbitelor pe care se deplasează electronul, deci nu pot avea orice valoare. O consecinţă a naturi ondulatorii a electronilor este structura în formă de scară a energiilor (vezi imaginea de mai jos).
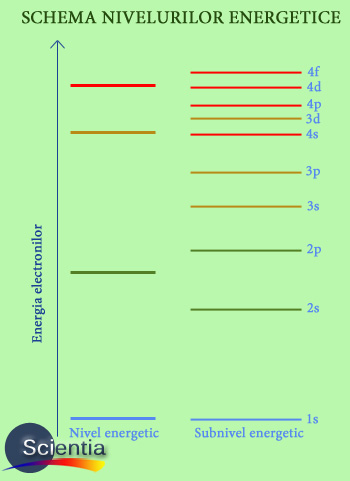
· Pentru detalii privind semnificaţia diferitelor niveluri energetice (1s, 2s etc.), citeşte articolul nostru: Modelul cuantic al atomului)
În funcţie de nivelul energetic, spunem că un electron se află în starea fundamentală (starea de energie minimă) sau în stări de excitaţie (cu energie mai mare). După absorbţia de energie, un electron poate să treacă de la un nivel de energie la următorul, pornind de la starea fundamentală şi ajungând la stări superioare de excitaţie.
În fine, răspundem la întrebarea din titlu...
Pentru ca atomul de hidrogen să fie stabil, pentru ca electronul să nu cadă în nucleu, avem nevoie de o nouă forţă, care să se opună pierderii de energie prin radiaţie electromagnetică. Această forţă apare atunci când distanţa dintre centrul funcţiei de undă şi proton e mai mică decât lăţimea undei.
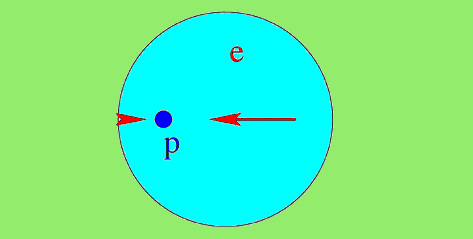
Funcţia de undă a electronului, reprezentată de cercul albastru, nu se poate afla strict doar de o parte a protonului.
Atracţia electrică din părţi diferite înseamnă forţe de respingere, iar aceste forţe dau stabilitate atomului.
Deşi cea mai mare parte a funcţiei de undă rămâne concentrată de o parte a protonului, o importantă parte este localizată de cealaltă parte. Nici protonul nu este, în fapt, un punct geometric, ca în reprezentarea clasică, ci trebuie descris tot ca o funcţie de undă. Distribuţia spaţială a funcţiei de undă a protonului este mult mai mică, din cauza masei mari a protonului, comparativ cu cea a electronului, şi nu joacă un rol important în povestea noastră.
Cum funcţia de undă ne dă probabilitatea poziţiei electronului, există posibilitatea ca electronul să se afle de cealaltă parte a protonului (în stânga protonului, în imaginea de mai sus). Electronul va fi în continuare atras de proton, dar forţa va indica în direcţia opusă, comparativ cu situaţia în care electronul se află în partea opusă (în dreapta, conform imaginii de mai sus) a protonului.
Rezultă, aşadar, o forţă de respingere, contrară atracţiei electrice dintre proton şi electron, care stabilizează atomul. Respingerea e maximă în cazul în care funcţia de undă este centrată pe proton, configuraţie ce corespunde stării fundamentale, stării de energie minime.
Aşadar, cheia misterului orbitării electronului în jurul nucleului, fără a cădea în acesta, stă în această forţă de respingere care apare la nivelul atomului, ca urmare a modului în care este distribuită funcţia de undă a electronului în raport cu protonul.
Sursa: Once Before Time. A Whole Story of the Universe, de Martin Bojowald
