
Datorită tensiunii artificiale și neaderenței la suprafața pe care se află, apa nu se răspândește pe toată suprafața
Umple un castron cu apă de la robinet și așază ușor un ac de cusut pe suprafața apei (poți să afli punctele cardinale astfel, pentru că acul se va alinia cu nordul magnetic și sudul magnetic ale Terrei). Dacă o să reușești asta, este pentru că apa prezintă ceea ce se numește „tensiune artificială”.
Acul pare că plutește, dar nu plutește, pentru că are o densitate mai mare decât densitatea apei. În fapt, suprafața apei respinge acul, încercând să-și păstreze forma inițială (o explicație detaliată o să găsești în continuarea articolului). Dacă nu crezi, tot ce trebuie să faci este să împingi un pic cu degetul acul; odată ce a trecut de suprafață, se va scufunda în apă rapid. Deci este ceva special cu suprafața apei și vom afla ce în continuare.
Tensiunea artificială este o proprietate a lichidului care face ca suprafața acestui lichid să reziste unei forțe externe (să reziste forței exercitate de acul de cusut, de exemplu). Motivul este natura legăturilor dintre moleculele lichidului.
În acest articol vom analiza tensiunea superficială în cazul apei. Pentru aceasta vom explica la nivel atomic cum se formează o moleculă de apă și cum interacționează moleculele de apă între ele. Poate că această explicație detaliată este nenecesară pentru unii, dar mi-am propus asta din două motive: întâi pentru că, sper, cine citește acest articol vrea să priceapă exact ce se întâmplă, iar în al doilea rând pentru că nu există nicio astfel de explicație exhaustivă pe Internet. Explicațiile pe care le găsiți, de regulă, vorbesc despre „forțe de coeziune” ori menționează alte forțe, dar nu explică ce anume este implicat în generarea acelor forțe. Aceste detalii pe care le veți întâlni în continuare sunt, deci, necesare pentru a înțelege ce este în fapt tensiunea superficială a apei.
Să începem prin a explica cum se formează o moleculă de apă și ce forțe guvernează la acest nivel.
Molecula de apă
Molecula de apă este formată din doi atomi de hidrogen și un atom de oxigen. Un atom de hidrogen este format dintr-un proton, care formează nucleul, și un electron. Atomul de oxigen are, în schimb, 8 electroni (2 pe primul strat energetic, 6 pe ultimul strat).
Molecula de apă se formează în felul următor: atomul de oxigen pune în comun doi electroni din cei șase de pe ultimul strat, iar doi atomi de hidrogen își pun în comun singurul lor electron, ca în imaginea de mai jos.
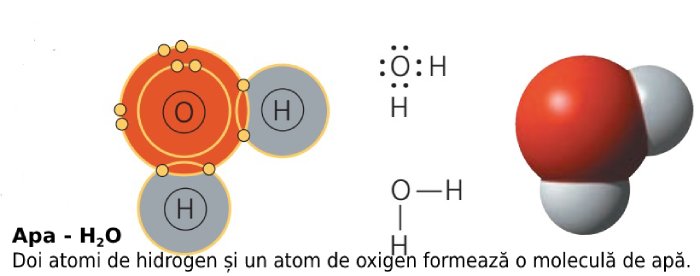
Electronegativitatea apei
Electronegativitatea se referă la capacitatea nucleului atomic de a păstra electronii de pe stratul energetic cel mai îndepărtat. Unii atomi, ca cei de oxigen, au electronegativitate mare, ceea ce înseamnă, metaforic vorbind, că „țin cu dinții” de electronii lor, pe când alți atomi, ca sodiul, au electronegativitatea foarte scăzută, adică renunță ușor la electronii de pe ultimul strat energetic.
Ce legătură are electronegativitatea cu apa?
Oxigenul are o electronegativitate mare în comparație cu atomul de hidrogen. Asta înseamnă că electronii puși în comun de atomii de oxigen și hidrogen sunt mai aproape (un fel de a spune...) de nucleul atomului de oxigen, oxigenul obținând în felul ăsta o sarcină negativă parțială (δ‾), iar hidrogenul o sarcină parțială pozitivă (δ+).
Așadar, pentru că electronii sunt mai aproape de nucleul oxigenului, iar electronii au sarcini negative, atomii de oxigen devin mai negativi. Apare o distribuție neuniformă a sarcinii în molecula de apă, care îi dă acesteia proprietățile foarte interesante pe care le are.
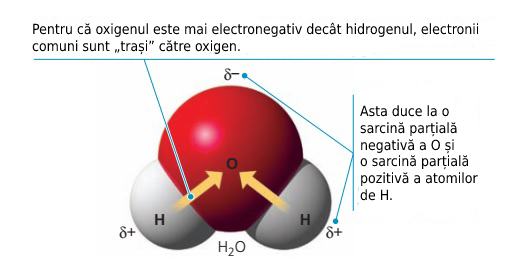
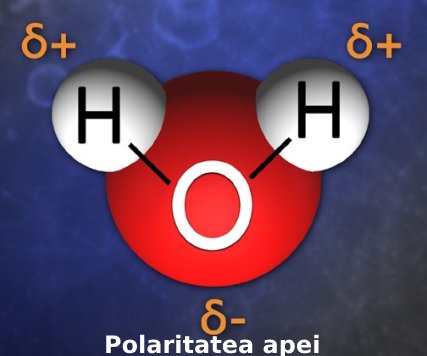
Legătură polară
Legătura chimică între atomii care pun în comun electroni se numește legătură covalentă. Când avem doi atomi cu electronegativitate diferită, cum e cazul oxigenului și hidrogenului, atunci numim legătura polară. Așadar, o moleculă de apă este polară, referindu-se tocmai la distribuția inegală a sarcinii explicată mai sus.
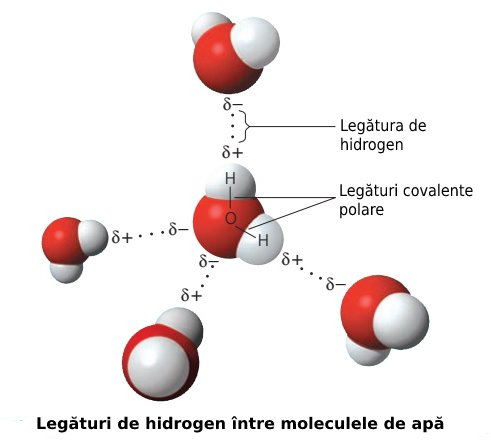
Legătura de hidrogen
Sarcinile parțiale pozitive ale hidrogenului sunt atrase de sarcinile parțiale negative ale oxigenului, căci sarcinile opuse se atrag. Acest tip de legătură se numește legătura de hidrogen.
Legătura de hidrogen nu se referă la legătura covalentă dintre atomii de hidrogen și oxigen care formează o moleculă de apă, ci la legătura care se formează între atomii de hidrogen ai unei molecule de apă și atomii de oxigen ai altei molecule de apă (vezi imaginea de mai jos).
Legăturile de hidrogen reprezintă motivul pentru care apa rămâne lichidă la temperatura camerei. Aceste legături se desfac ușor, nu sunt permanente, fiecare moleculă de apă formând și încetând aceste legături continuu cu moleculele de apă din jur. Este ceea ce dă apei caracterul fluid, maleabilitatea, capacitatea de a lua forma oricărui vas.
Legătura de hidrogen este esențială în înțelegerea tensiunii superficiale. Acum că știți ce forțe acționează la nivelul apei, putem discuta despre cum se formează și cum se manifestă tensiunea superficială.
Cum funcționează tensiunea superficială?
Moleculele de la suprafața apei nu au alte molecule de apă în toate direcțiile (cum au moleculele din interiorul masei de apă), ci doar în lateral și sub și, în consecință, acestea aderă mai puternic la moleculele din proximitate. Această coeziune puternică dintre moleculele de apă de la suprafață face mai dificilă trecerea unui obiect prin suprafața apei decât deplasarea acestuia atunci când este complet scufundat (vedeți exemplu de mai sus cu acul de cusut, care odată trecut „bariera” suprafeței apei, se scufundă).
Dar de ce există această coeziune puternică între moleculele de apă la suprafață? În interiorul lichidului fiecare moleculă este atrasă în egală măsură în toate direcțiile de către moleculele învecinate, rezultanta tuturor forțelor fiind nulă în raport cu centrul de masă al moleculei de apă considerate. Când vorbim de atracție între moleculele de apă, vorbim despre legătura de hidrogen, explicată mai sus.
La suprafața lichidului însă, moleculele sunt atrase înspre interior de alte molecule aflate în adâncimea lichidului și mai puțin de moleculele din mediul învecinat (în principiu, aer). Așadar, moleculele de la suprafață sunt, natural, supuse unei forțe de atracție moleculară îndreptate spre interior, echilibrată în celălalt sens doar de rezistența la compresie a lichidului, ceea ce asigură forma plată a suprafeței apei.
În plus, tot sub acțiunea forțelor moleculare din interiorul lichidului, suprafața lichidului tinde să ia forma ce corespunde celei mai mici suprafețe locale. În acest fel se formează picăturile, care au formă sferică (deformată, sub influența gravitației), pentru că sfera asigură forma de arie minimă a suprafeței (dintre toate corpurile geometrice, forma sferică posedă, la un volum determinat, cea mai mică arie).

Rouă formată pe o frunză.
Cum apa nu aderă la suprafața frunzei, picătura păstrează o formă aproape sferică, deformată puțin de gravitație.
Cum ați văzut mai sus, acul de cusut este practic ținut la suprafață de apă. O explicație a acestui lucru este următoarea: orice curbură a formei suprafeței duce la mărirea ariei. Suprafața apei va tinde continuu spre realizarea ariei minime, ceea ce se traduce prin împingerea oricărui obiect care deformează (mărește aria) suprafața masei de apă.
Așadar, în esență, tensiunea superficială este rezultatul tendinței unei mase de apă de a păstra forma suprafeței sale, ca urmare a manifestării legăturii de hidrogen între moleculele de apă. Moleculele de apă de la suprafață au legături mai strânse între ele, blocând, până la un punct, încercarea unui obiect de a rupe aceste legături.
Vă invit să urmăriți un scurt videoclip produs de BBC (4 min.), în care este filmat în „slow motion” modul în care suprafața apei (tensiunea superficială) respinge o picătură de lapte și cum anumite insecte se folosesc de tensiunea superficială a apei pentru a se deplasa.
Stratul de suprafață al apei (ținut împreună de tensiunea superficială) creează o barieră între atmosferă și apă. Fapt interesant, în afară de mercur, apa are cea mai mare tensiune superficială dintre toate lichidele.
De ce apa caldă spală mai bine decât apa rece
Tensiunea superficială scade odată cu temperatura. De aceea apa fierbinte este mai eficientă la spălarea hainelor, pentru că permite substanțelor chimice adăugate (săpun sau detergent) să intre în porii acestora. În plus, detergentul este astfel creat pentru a scădea și mai mult „tăria” tensiunii superficiale.
Dacă unii producători recomandă o temperatură mai scăzută a apei, motivul este că prin folosirea unei ape prea calde țesătura va fi îmbibată de apă și detergent în așa fel încât haina respectivă nu va mai arăta la fel după spălare: probabil va fi mai decolorată.
Cum se comportă apa în condiții de microgravitație
În videoclipul de final al articolului, vă invităm să urmăriți un scurt experiment efectuat pe Stația Spațială Internațională, în care puteți observa cum se comportă o picătură de apă în condiții de microgravitație.
⇒ Un caz aparte este atunci când temperatura scade sub zero grade Celsius. Citiți și: De ce gheața plutește
