
Probabil că ați văzut în sutele de filme americane difuzate la televizor măcar o dată o baterie făcută dintr-un cartof cu două fire atașate unui bec. Poate chiar ați învățat la școală despre ele, dar doar foarte pe scurt. Cum funcționează, totuși, aceste baterii, la nivel atomic? Oare chiar energia vine din cartof sau vine de altundeva?
Prima baterie
Pentru a înțelege reacțiile ce au loc în interiorul unei baterii din cartof (da, bateriile se bazează pe reacții chimice pentru a produce energie), trebuie să dăm timpul înapoi până în 1800, când Alessandro Volta a inventat prima baterie, pila voltaică, numită și pila Volta. Volta a observat că dacă pune un disc de hârtie îmbibată într-un electrolit (în cazul pilei voltaice, apă cu sare) între un disc de cupru și un disc de zinc, o mică tensiune electrică se formează la conectarea celor două discuri de metal cu un fir. Această structură simplă se numește celulă voltaică, iar prin suprapunerea mai multora se poate obține o pilă voltaică, prima baterie.
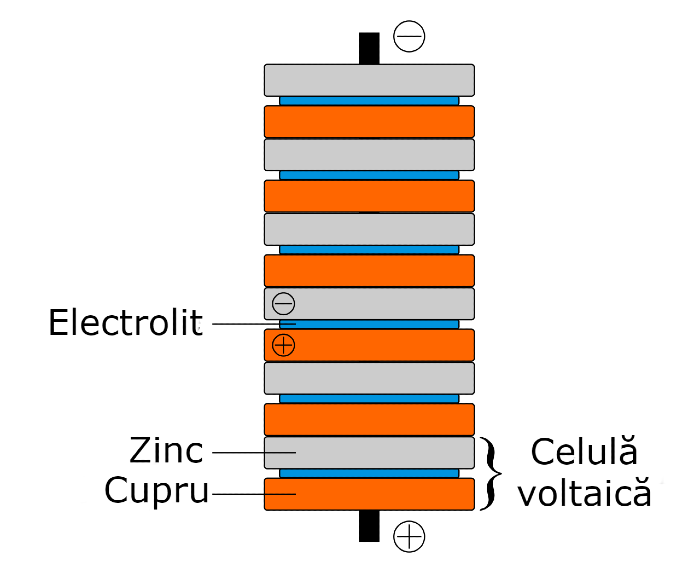
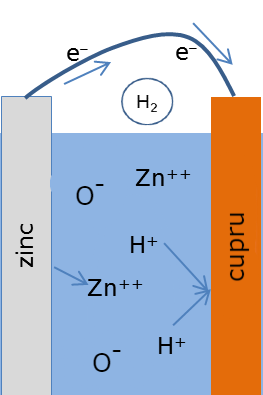
Funcționarea acestei baterii, a tuturor bateriilor de fapt, nu ar fi posibilă fără existența reacțiilor redox (oxido-reducere). După cum a observat și Volta, în urma folosirii bateriei, discurile de zinc deveneau uzate, fiind roase în locurile unde făceau contact cu hârtia îmbibată în saramură. La nivel atomic avea loc o reacție de tip redox. Mai întâi, datorită forțelor intermoleculare exercitate de soluția de apă cu sare, atomii de zinc de pe suprafața discului începeau să fie dizolvați în soluție, devenind ioni cu sarcină pozitivă și eliberând 2 electroni de pe ultimul lor strat electronic. Aceasta era partea de odixare a reacției, întrucât atomul de zinc pierdea electroni (oxigenul nu are nicio legătură cu reacția de oxidare). În timp ce zincul era dizolvat, doi ioni de hidrogen primeau câte un electron fiecare de pe suprafața discului de cupru, pentru a deveni o singură moleculă de hidrogen cu sarcină electrică zero. Aceasta era partea de reducere a reacției, completând reacția redox.
Ok, dar unde este electricitatea? Dacă ne aducem aminte, în urma reacției de oxidare a zincului, doi electroni au rămas în plus în discul de zinc, dându-i o sarcină negativă, iar în urma reacției de reducere a hidrogenului, discul de cupru a rămas cu doi electroni lipsă, dându-i o sarcină pozitivă. Această diferență de sarcini creează o tensiune electrică între cele două metale, iar astfel are loc un transfer de energie, întrucât electronii din discul de zinc încearcă sa ajungă în discul de cupru pentru a echilibra sarcinile.
Și ce legătură au cartofii cu pila voltaică?
Deși Volta nu a realizat acest lucru când a inventat pila voltaică, electrolitul folosit joacă un rol foarte important în funcționarea bateriilor, luând parte în toate aspectele reacției redox, dizolvând zincul și oferind hidrogenul reactiv ce „fură” electronii cuprului. Electrolitul nu trebuie, însă, să fie apă cu sare. În urma multiplelor experimente făcute s-a observat faptul că multe soluții acide pot fi folosite drept electrolit, inclusiv acidul citric (C6H8O7), găsit în lămâi, sau acidul fosforic (H3PO4), găsit în cartofi.
Aha! Deci de asta pot fi cartofii folosiți pentru a produce electricitate (în cantități mici, bineînțeles). Dacă punem o bucată de zinc într-un cartof și o bucată de cupru, iar apoi le conectăm printr-un fir pentru a completa circuitul, aceeași reacție redox va avea loc în cartof precum cea din pila voltaică a lui Volta.
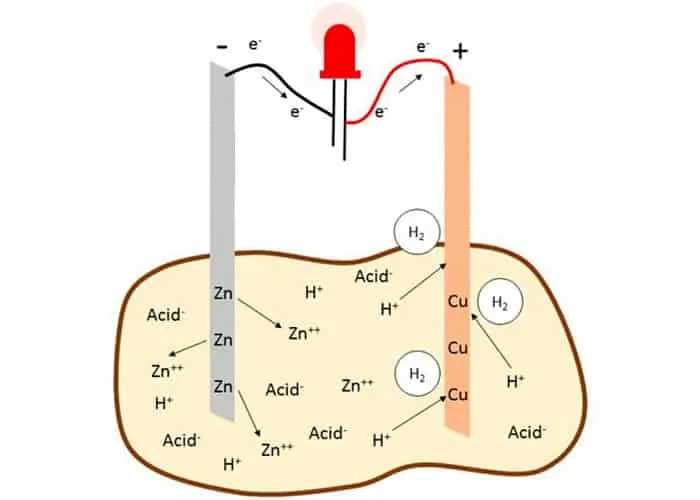
În concluzie știm cum să transformăm până și un cartof sau o lămâie într-o baterie rudimentară mulțumită cercetărilor lui Alessandro Volta și a multor altora din domeniul electrochimiei.
Cine știe când vei avea nevoie de o baterie și tot ce vei avea la îndemână va fi un cartof, o monedă de 5 bani (pentru cupru) și un cui de oțel anodizat (pentru zinc)?
Nu recomandăm să mâncați cartoful, însă, după ce îl folosiți ca baterie :)

